2021年6月21日,生命中心魏文胜课题组在Nature Biotechnology杂志在线发表了题为 “Genome-wide interrogation of gene functions through base editor screens empowered by barcoded sgRNAs”的研究论文。
基于CRISPR-Cas的功能性筛选技术为基因功能研究和药物靶点发现提供了有力手段。经典的CRISPR敲除筛选方法依赖于Cas9介导的双链DNA断裂。然而,DNA双链断裂的产生如果修复不及时会造成严重的细胞损伤。因此,Cas9靶向基因组多拷贝位点时极易引起细胞死亡,从而影响基因功能筛选的准确性。此外,在对基因组损伤更为敏感的原代细胞中,基因编辑产生的DNA切割会激活p53信号通路,从而引起细胞周期停滞乃至细胞死亡,使得在细胞中进行大规模筛选比较困难。比如在有野生型p53表达的人视网膜色素上皮细胞中,经典CRISPR基因敲除筛选呈现出信噪比过低的结果;在人多能干细胞中,对单个基因组位点的编辑也同样容易造成细胞死亡。近期有多篇报道针对如何在原代细胞中实现大规模基因组功能性筛选的技术方案展开了争论和探讨,但始终没有令人满意的解决方案。
针对上述问题,魏文胜课题组发展了名为iBARed cytosine Base Editing-mediated gene KnockOut (BARBEKO)的新型筛选方案。该方法利用胞嘧啶单碱基编辑器,通过靶向破坏蛋白质编码基因的起始密码子位点或剪接位点、或通过引入提前终止密码子的方式来实现非依赖DNA双链断裂的高效基因敲除。通过结合实验室之前建立的内置分子条形码(iBAR)设计sgRNA (Zhu et al. Genome Biology 2019),BARBEKO方案可以依赖高病毒感染复数建库,在提升筛选效率的同时极大减少了所需细胞数量。相较于经典的CRISPR基因敲除筛选,BARBEKO方法能将筛选所需细胞量降低10-100倍,并能够通用于正向和负向选择筛选,可以大幅提升全基因组水平功能性筛选的可行性与经济性。
BARBEKO方法成功在多种癌细胞系和表达野生型p53的正常细胞中实现了准确、高效的细胞适应性(fitness)筛选。该方法能有效避免基因拷贝数效应,有效降低负向筛选中与细胞死活相关的高假阳性率;在对DNA双链断裂敏感的细胞系中,该方法在筛选精度和准确率方面优势尤为明显(图1)。这些结果表明,BARBEKO方法为原代细胞、类器官或模式动物体内等复杂生物模型的高通量筛选提供了更优的选择;为数量受限的细胞样品(如病人来源的细胞)提供了高效筛选方案,因此是基因功能和临床前研究的有力工具。
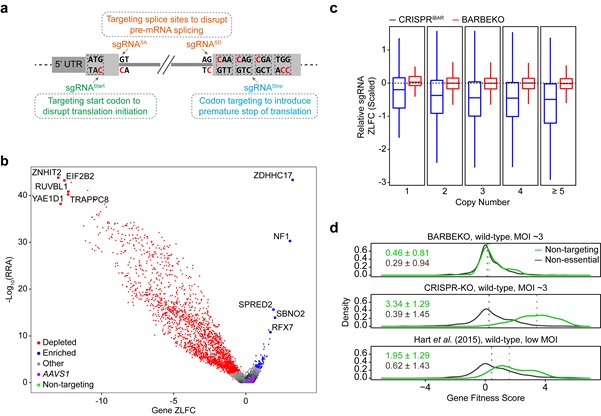
图1 | BARBEKO筛选策略有效提升基因敲除筛选效率和准确性
北京大学魏文胜课题组博士生许萍、刘志恒博士、刘莹博士和博士生马华峥为该论文共同第一作者。该研究项目得到了国家自然科学基金重点项目、北京市科委生命科学前沿创新培育项目、北京未来基因诊断高精尖创新中心和生命科学联合中心的基金支持。
原文链接:https://www.nature.com/articles/s41587-021-00944-1

