T细胞急性淋巴细胞白血病(T-Lineage Acute Lymphoblastic Leukemia, T-ALL)是血液系统常见的恶性肿瘤。虽然联合化疗大大改变了T-ALL的疗效,但仍有20%的儿童和50%的成人T-ALL患者死于这种疾病。近期对T-ALL队列的外显子组及转录组测序鉴定出一系列T-ALL驱动基因及信号通路异常,大大推动了对T-ALL病理机制的了解。然而上述研究都局限于编码序列,考虑到T-ALL的基因突变显著低于其它癌症,寻找基因组非编码区突变及基因组结构变异是研究T-ALL分子机制的重要方向。北京大学、生命科学联合中心吴虹教授、清华大学张奇伟教授与北京大学人民医院、生命科学联合中心黄晓军教授的研究团队合作应用Hi-C技术检测中国人群T-ALL基因组三维结构。该研究整合病人Hi-C与RNA-seq数据揭示了染色质结构变化导致高风险致癌转录因子HOXA13激活的分子机制。研究结果于2021年6月17日以“3D Genome Alterations Associated with Dysregulated HOXA13 Expression in High-Risk T-Lineage Acute Lymphoblastic Leukemia”为题在线发表在Nature Communications。
通过比对T-ALL与正常T细胞之间的三维基因组和基因表达差异,研究者发现T-ALL中29%的差异表达基因存在不同尺度基因组三维结构变化,提示T-ALL基因组三维结构改变同基因表达差异密切相关。研究人员同时在14例病人样本中共检测到46个染色体易位事件,其中34个为首次报道,47%的相关断点处于非编码区。在检测出染色体易位的病人样本中,染色体易位都直接导致了致癌转录因子的异常表达,说明染色体易位是T-ALL的最主要驱动因素。研究人员继而对导致致癌转录因子HOXA13表达的染色体易位事件进行了深入分析发现,染色体易位通过两种方式改变HOXA13处的基因组结构并激活其表达: 一类染色体易位通过形成的融合蛋白结合于HOXA13的调控元件,激活HOXA13增强子,导致HOXA13表达;而另外一类则通过“增强子劫持”(enhancer hijacking)激活HOXA13表达。结合临床数据及外显子组数据分析发现HOXA13的表达同T-ALL病人的不良预后相关,HOXA13阳性病人更富集JAK-STAT通路突变,提示临床检测HOXA13表达可以帮助鉴别T-ALL易复发病人,HOXA13阳性病人可能会得益于JAK-STAT通路抑制剂治疗。
综上所述,该研究基于Hi-C测序数据,结合RNA-seq, ATAC-seq及H3K27ac ChIP-seq等多组学数据,以高分辨率刻画了T-ALL中基因同调控元件相互作用图谱,首次揭示了基因组三维结构改变导致HOXA13在T-ALL中异常表达的机制,提示HOXA13的表达可以作为T-ALL预后标志物。该研究对理解T-ALL发病的分子机制,以及T-ALL靶向治疗都具有重要意义和价值,也为其它癌症的三维基因组研究提供了范式。
北京大学生命科学学院、生命科学联合中心吴虹教授,清华大学张奇伟教授和北京大学人民医院血液科主任、生命科学联合中心黄晓军教授为本文的共同通讯作者。吴虹实验室助理研究员杨璐,张奇伟实验室博士研究生陈凤玲和吴虹实验室博士研究生祝海川为本文共同第一作者。该研究得到生命科学联合中心、国家自然科学基金委以及细胞增殖与分化教育部重点实验室的资助。
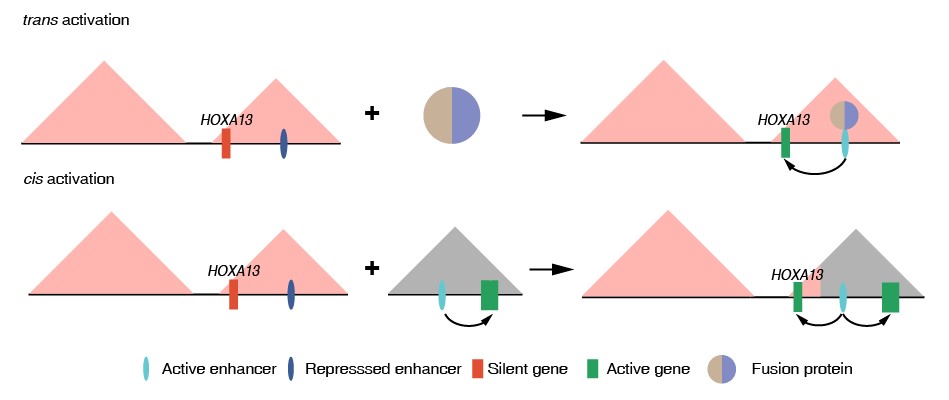
染色体易位导致HOXA13激活的分子机制示意图
原文链接: https://www.nature.com/articles/s41467-021-24044-5

