摘要
2018年4月26日,北京大学-清华大学生命科学联合中心,北京大学分子医学所研究员陈雷研究组与迪哲医药有限公司首席执行官、北京大学分子医学所客座教授 张小林博士合作,在《细胞研究》杂志发表题为《人源受体激活的TRPC6和TRPC3通道结构》(Structure of the receptor-activated human TRPC6 and TRPC3 ion channels)(链接:https://www.nature.com/articles/s41422-018-0038-2),报道了人源TRPC6(3.8Å)和TRPC3(4.4Å)通道的冷冻电镜结构,揭示了TRPC通道组装模式,为进一步研究其工作机制提供了结构模型。
正文
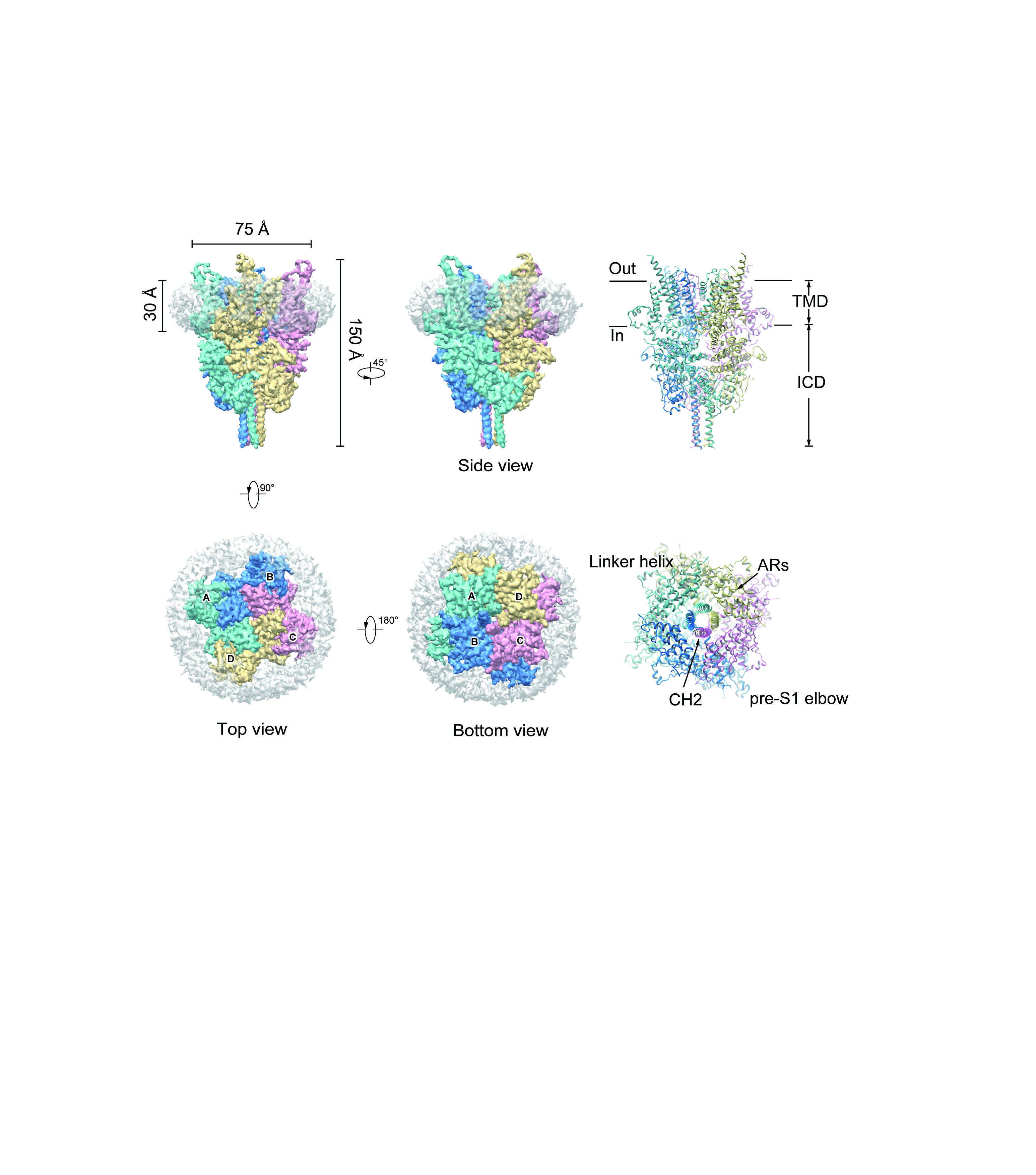
在果蝇光感受机制的研究过程中,人们发现并克隆了TRP通道。随后果蝇TRP通道在哺乳动物中的同源通道蛋白也被逐一发现并克隆,它们组成了庞大的TRP通道家族。其中TRPC(TRPC1-7)通道亚家族和果蝇中TRP通道同源度最高。而TRPC3/6/7亚类也像果蝇TRP通道一样,可以被受体偶联的磷脂酶C(PLC)水解PIP2 所生成的DAG所激活,因此被称为受体激活的TRPC通道亚类。这些受体激活的TRPC通道开放后会导致膜电位的去极化和钙离子的内流。它们广泛的分布于人体组织,并参与了多种生理过程,例如神经突触形成、运动协调、肾功能、伤口愈合、癌症扩散、平滑肌收缩及诱导心肌肥大等。值得一提的是TRPC6对于肾小球脏层足细胞足突形成过程至关重要。TRPC6激活突变可以导致家族遗传性局灶性节段性肾小球硬化(FSGS),这是临床上导致大量蛋白尿的一个病因,其中部分患者比较快地发展至终末期肾功能衰竭,目前没有较好的临床疗法。而开发针对TRPC6的抑制剂是治疗该类肾病的一个 较有前途的方向。尽管TRPC6通道如此重要,但其分子水平上的工作机制仍不清楚,归根结底是因为缺乏TRPC6通道高分辨率的结构信息。
近年来,得益于冷冻电镜技术的飞速发展,除了TRPC家族以外,其它TRP通道家族的结构都已经得到了解析。而TRPC通道除了6次跨膜螺旋构成的孔道区以外,还具有较大的胞内N端结构域及C端结构域,这些结构域是如何参与组装TRPC通道四聚体的仍不为人知。张小林博士首先开发了针对TRPC6通道的高亲和力抑制剂,陈雷研究组通过冷冻电镜技术解析了TRPC6通道与抑制剂复合物的分辨率为3.8Å的结构,同时也解析了TRPC3通道分辨率为4.4Å的结构。这两个结构清晰地展示了TRPC通道的组装模式。通过对突变体的功能研究及结构比对,抑制剂的结合位点也得到了确认。
该项工作由陈雷研究组和迪哲医药有限公司共同完成,其中分子医学所二年级学生汤晴麟和郭文君为共同第一作者。该工作最终的冷冻电镜数据采集在上海国家蛋白质科学设施 和北京大学冷冻电镜平台完成,数据处理得到了北京大学CLS计算平台和未名一号高性能计算平台的支持。此外,生物物理所冷冻电镜平台在前期的工作中给予一定支持。本工作获得科技部重点研发计划、国家自然科学基金委、生命科学联合中心的经费支持。