小鼠胚胎发育由合子开始,经过2细胞、4细胞、8细胞和桑椹胚,形成囊胚,之后继续发育形成胚内和胚外组织。具有最高潜能的干细胞被称为全能性干细胞,一般指体内的合子,2/4细胞,它可以发育到胚内和胚外组织。多能性干细胞,一般来源于囊胚的内细胞团,它的发育潜能是受限的,只能发育到胚内组织。1981年,人们首次在体外成功分离了第一株小鼠多能性胚胎干细胞系(ESC)。直到40年后的今天,所有培养的小鼠胚胎干细胞都处于多能状态,人们一直致力于体外建立发育潜能更高的干细胞。表达全能性基因Zscan4s和Mervl的2C-like细胞是最早报道的能够产生胚内和胚外组织的细胞[1]。但是,2C-like细胞在培养基中是亚稳态的,仅以极低的百分比(0.1%-1%)存在。2017年,两个研究小组报道使用不同的化学小分子混合物建立了扩展型多能干细胞(Expanded (or extended) pluripotent stem cell,EPSC),具有胚内和胚外双向分化潜能 [2, 3]。但是,这种扩展型多能性干细胞的分子特征和功能等方面和体内真正的全能性胚胎细胞仍存在较大差距[4]。迄今为止,人们无法在体外捕获和维持分子和功能上与体内全能性胚胎相似的全能性干细胞,因此也就无法真正利用体外细胞培养体系研究着床前胚胎发育过程,并且导致胚外组织的体外分化及相关转化医学应用等方面也存在极大的局限性。
2021年5月14日,北京大学杜鹏课题组在Cell杂志在线发表了题为“Mouse totipotent stem cells captured and maintained through spliceosomal repression”的研究论文。在这项研究中,作者通过抑制剪接体,实现了小鼠全能性干细胞的体外建立和培养,且这种细胞在分子和功能上接近体内2细胞和4细胞时期胚胎,因此被命名为totipotent blastomere-like cells(TBLCs)。

在本研究工作中,作者主要有以下发现:
1、剪接体抑制驱动多能干细胞到全能干细胞的转变
作者分析了先前发表的单细胞胚胎数据,发现剪接因子在早期胚胎发育中是动态变化的,有一类剪接因子在胚胎发育早期低表达,在后期表达量逐渐升高。作者发现敲低这一类关键剪接因子能广泛激活全能性基因(如Zscan4s,Plk2,Btg1/2以及转座子Mervl和Mt2),沉默多能性基因(如Utf1,Tdgf1,Sox2),将小鼠多能性的ESC重编程为全能性状态。同时,将剪接抑制剂Pladienolide B(PlaB)添加到Serum/ LIF培养基中(SLP培养基),能够在体外培养和维持TBLC,且细胞活性和核型正常。与PSCs (pluripotent stem cells) (P0)相比,在SLP培养基中培养5代之后,整体转录组趋于稳定,特异性表达胚胎时期的全能性基因,沉默囊胚时期特异性表达的多能性标记基因,接近体内胚胎的2细胞和4细胞时期(图1)。其次他们发现撤去PlaB后,TBLCs细胞能够转换到多能性状态(图1),说明单个剪接抑制剂PlaB可以操纵这个多能/全能干细胞转换过程。SLP培养条件提供了一个可靠的体外系统来研究全能到多能细胞的转换,且这个系统在分子水平上能够模拟从体内2细胞时期到囊胚时期的发育。
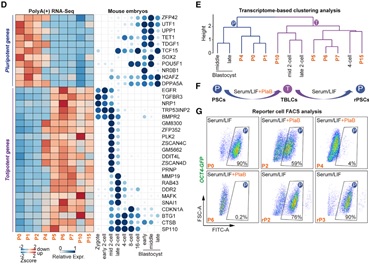
图1 TBLC转录组稳定,且接近体内2细胞和4细胞时期胚胎
2、TBLC在单细胞转录组、翻译组、DNA甲基化组和染色质可及性上具有与2细胞和4细胞时期相似的分子特征
作者首先对PSCs和TBLCs进行了单细胞转录组测序。使用23个多能性标记基因和30个全能性基因以及转座子Mervl和Mt2,区分了PSC和TBLC,发现几乎所有的TBLC来自SLP培养基,说明SLP培养基能培养和维持TBLC细胞的同质性(图2)。此外,翻译组测序(Ribosomal profiling,Ribo- seq)显示,与PSCs相比,TBLCs在翻译组水平上全能性基因表达上调,多能性标记基因表达下调。作者使用全基因组亚硫酸氢盐测序法(Whole-Genome Bisulfite Sequencing,WGBS)来表征PSCs和TBLCs的DNA甲基化组,发现PSCs中的整体甲基化水平为71%,接近E6.5-E7.5时期胚胎;而TBLCs与之相比甲基化水平大幅降低至35%,类似于体内2细胞和4细胞胚胎(整体甲基化程度分别为47%和41%)。染色质可及性测序ATAC-seq(Assay for Transposase-Accessible Chromatin using sequencing)结果显示,与PSCs相比,TBLCs在转录起始位点(TSS)附近的开放峰和封闭峰与小鼠2细胞和4细胞胚胎时期显示出相似的开放或封闭状态,这意味着TBLCs具有与早期胚胎相似的染色质可及性。综上,作者使用单细胞测序以及多组学分析,表征了与体内全能性胚胎相似的TBLCs在转录组,DNA甲基化组,染色质可及性和翻译组上的分子特征。
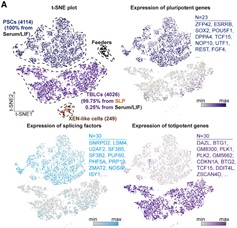
图2 SLP培养基能培养和维持TBLC细胞的同质性
3、TBLC与EPSCs和2C-like细胞不同,在分子水平上靠近2细胞和4细胞时期胚胎
此外,作者比较了TBLCs与已发表的EPSCs和2C-like细胞的转录组测序数据,发现与TBLCs细胞中大多数多能性标记基因被广泛沉默不同,EPSCs仍明显表达多能性标记基因;而在TBLCs中高表达的全能性基因或转座子在EPSCs中表达量很低。最后,作者对TBLCs和EPSCs与小鼠植入前胚胎数据进行了基于转录组的主成分分析以及与2C-like细胞的相关性分析(图3),发现TBLCs明显靠近2细胞和4细胞时期胚胎,EPSCs和2C-like细胞接近多能性囊胚时期,这与最近一个研究组得到的结论一致[4]。
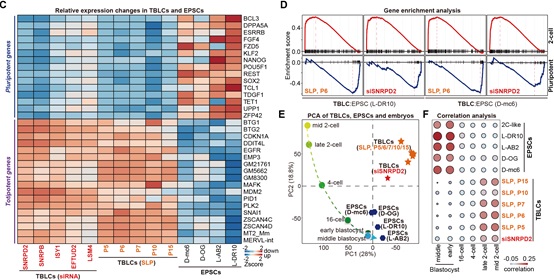
图3 TBLC与EPSC和2C-like细胞不同,更接近2细胞和4细胞时期胚胎
4、TBLC具有双向分化潜能,能够产生多种胚内和胚外细胞谱系
作者进行的功能嵌合实验表明,TBLC具有强大的双向发育潜能,可以产生胚内和胚外组织,包括囊胚时期的TE,E6.5-E7.5胚胎的EPC和ExE,以及发育后期的胎盘和卵黄囊。更重要的是,作者还观察到来源于单个TBLC的荧光标记细胞可以嵌合进入整个E6.5-E7.5胚胎,包括EPI,ExE和EPC(图4)。小鼠胎盘是一个富含血液的复杂器官,为了避免免疫染色产生的假阳性,作者将E13.5嵌合小鼠的胎盘和卵黄囊消化成单细胞,并通过流式富集筛选出有荧光标记的TBLC来源的细胞进行单细胞测序,发现其能够在小鼠体内分化为至少6种胚外和15种胚内细胞类型。本篇文章首次利用单细胞转录组准确追踪出供体细胞的发育谱系,为全能性细胞的功能性检验提供了一个更严格的检验方法。作者使用单细胞测序,证明了TBLC能够在胎盘和卵黄囊中分化为至少6种胚外和15种胚内细胞类型(图5)。
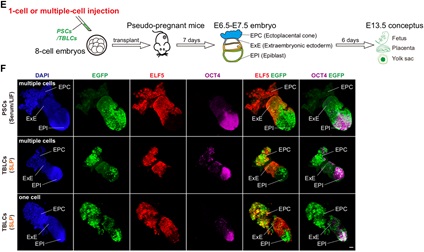
图4 TBLC在E6.5-E7.5的嵌合胚胎中能分化到胚内和胚外组织
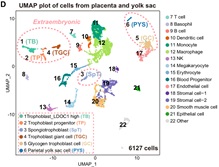
图5 单细胞水平上鉴定TBLCs能够分化到多个胚内和胚外细胞谱系
最后,作者发现,在小鼠胚胎干细胞中,动态剪接体阻遏导致了广泛的内含子积累,从而导致多能性基因表达下降,而全能性基因仍然可以被有效地剪接并激活,这可能与全能性基因拥有短而少的内含子的独特基因特征有关,但是更详细的机制还需要继续探索。
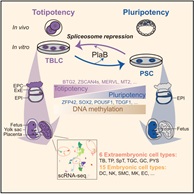
综上,此项研究首次建立了体外捕获和培养全能性干细胞的方法,而且令人惊奇的揭示了剪接体在干细胞命运转变中的重要决定作用。故此,该成果不但对于早期胚胎发育相关的基础研究提供了新的体外研究体系,同时也为未来干细胞相关的临床医学研究提供了新型的发育潜能极高的“种子细胞”来源。
北京大学生命科学学院/北大-清华生命科学联合中心的杜鹏研究员为该论文的通讯作者。北京大学前沿交叉学科研究院博士研究生申辉,生命科学学院博士研究生杨敏和前沿交叉学科研究院博士研究生李诗雨为本文的并列第一作者。清华大学生命科学学院张静、常在,北京大学博士研究生彭冰、汪春晖和博士后翁健莉对本文有重要贡献。该项目得到了国家自然科学基金、北京大学“细胞增殖与分化”教育部重点实验室、北大-清华生命科学联合中心的资助。
原文链接:https://doi.org/10.1016/j.cell.2021.04.020
博士后招聘:
北京大学杜鹏实验室依托于北京大学生命科学学院和北大-清华生命科学联合中心,从事RNA调控,干细胞及肿瘤生物学的相关研究。主要致力于分析和鉴定未知的RNA调控通路,并研究相关RNA调控通路在胚胎干细胞的分化命运决定和早期胚胎发育中的功能。同时也尝试于在动物细胞中重组植物或微生物中特异的RNA调控通路,并研究其潜在的转化医学中的应用。现诚聘博士后2-3名。详细信息请见链接:http://www.bio.pku.edu.cn/homes/Index/news_cont/37/15569.html
参考文献:
1 Macfarlan, T.S., Gifford, W.D., Driscoll, S., Lettieri, K., Rowe, H.M., Bonanomi, D., Firth, A., Singer, O., Trono, D., and Pfaff, S.L. (2012). Embryonic stem cell potency fluctuates with endogenous retrovirus activity. Nature 487, 57–63.
2 Yang, J., Ryan, D.J., Wang, W., Tsang, J.C., Lan, G., Masaki, H., Gao, X., An- tunes, L., Yu, Y., Zhu, Z., et al. (2017a). Establishment of mouse expanded po- tential stem cells. Nature 550, 393–397.
3 Yang, Y., Liu, B., Xu, J., Wang, J., Wu, J., Shi, C., Xu, Y., Dong, J., Wang, C., Lai, W., et al. (2017b). Derivation of Pluripotent Stem Cells with In Vivo Embry- onic and Extraembryonic Potency. Cell 169, 243–257.e25.
4 Posfai, E., Schell, J.P., Janiszewski, A., Rovic, I., Murray, A., Bradshaw, B., Ya- makawa, T., Pardon, T., El Bakkali, M., Talon, I., et al. (2021). Evaluating toti- potency using criteria of increasing stringency. Nat. Cell Biol. 23, 49–60.

