人类历史上,大麻已被驯化并使用了数千年。完成于汉代的中国最古老的药书《神农本草经》中记载:“麻蕡(即大麻果实),味辛平。主五劳七伤,利五脏,下血,寒气。多食,令人见鬼,狂走。久服,通神明,轻身”,这不仅介绍了大麻的药学功效,还描述了人摄入大麻所引发的幻觉等精神活动的变化。现在人们已经知道,古书上所记载的大麻对人精神活动的影响是由其天然成分大麻素类分子进入人体后作用在内源大麻素系统而实现的。
图一:大麻形态示意
内源大麻素(endocannabinoids, eCBs),包括花生四烯酸甘油酯(2-Arachidonoylgylcerol,简称2-AG)和花生四烯酸乙醇胺(N-arachidonoylethanolamide,简称AEA),是由神经元合成和释放的一类脂类神经调质分子。经典神经递质从突触前末梢释放,激活突触后膜受体;而eCB“反其道而行之”——在突触后神经元释放,逆行性地作用在特定类型神经元突触前膜大麻素受体CB1R(Cannabinoid receptor type 1)上,发挥突触前抑制作用。近二十年来的研究发现,eCB参与大脑多个脑区,包括皮层、海马、纹状体、杏仁核、下丘脑和黑质等,的突触可塑性调节,对维持神经系统的正常功能至关重要,与奖赏行为、能量代谢、学习记忆、睡眠觉醒、情绪等多种生理过程密切相关。内源大麻素系统的调控异常也与神经退行性疾病、癫痫、成瘾、抑郁症和精神分裂症等诸多神经疾病和精神类疾病密切相关。然而,目前缺乏高灵敏度、高时空分辨率的实验手段直接检测在体eCB的动态变化,极大地限制了人们对其在生理和病理状态下重要功能和分子调控机理的研究。
2021年11月11日,北京大学、生命科学联合中心李毓龙实验室在Nature Biotechnology杂志在线发表了题为A fluorescent sensor for spatiotemporally resolved imaging of endocannabinoid dynamics in vivo的研究论文,报道了新型基因编码的内源大麻素探针GRABeCB2.0的开发和在体内外多种场景下的应用。李毓龙实验室自2018年以来,先后开发了针对乙酰胆碱、多巴胺、去甲肾上腺素、腺苷、五羟色胺等神经递质/调质的荧光探针,此次发表的GRABeCB2.0是其又一力作,进一步扩展了GRAB系列荧光探针家族。

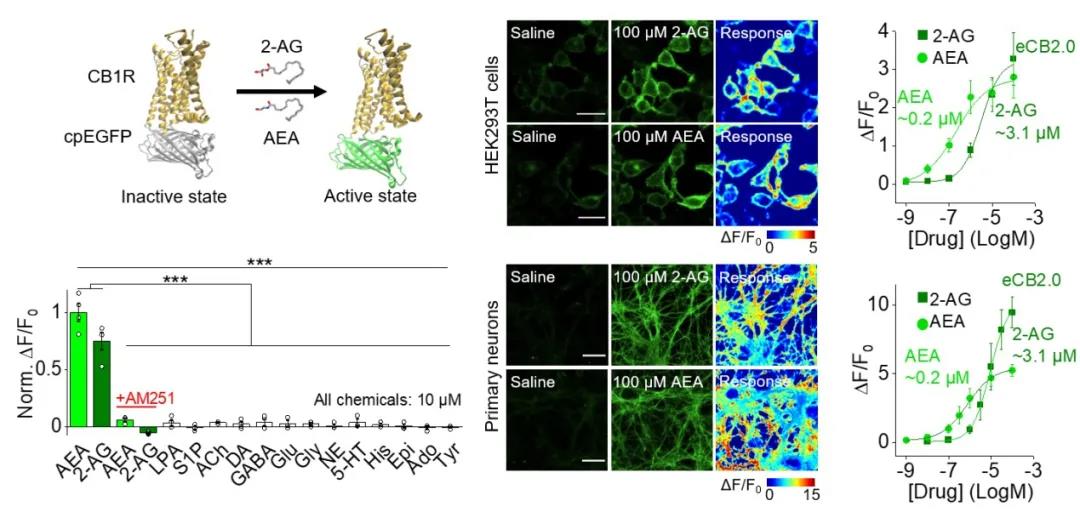
在这一工作中,李毓龙实验室运用其先前设计的GRAB探针策略 (GPCR activation-based sensor),基于人源大麻素受体CB1R和循环重排的绿色荧光蛋白cpEGFP开发了eCB探针eCB2.0。在体外培养的HEK293T细胞和原代神经元中,eCB2.0探针均表现出良好的细胞膜定位,对外源加入的大麻素AEA和2-AG有亚微摩至微摩级的亲和度,秒级的动力学响应和高度的分子特异性(图二)。此外,eCB2.0探针不会激活GPCR下游信号通路,表明探针本身对细胞的正常生理活动没有明显影响。
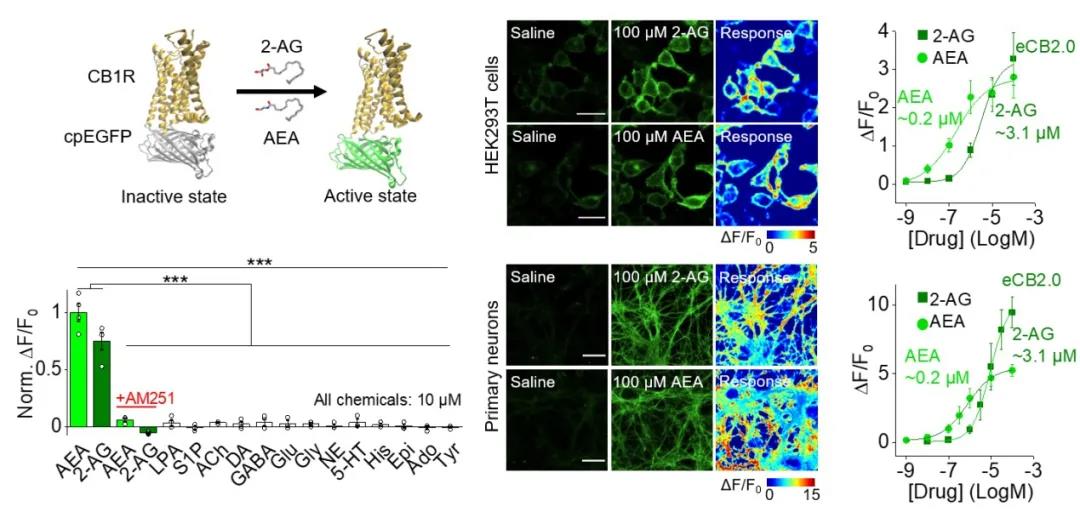
图二:eCB2.0在HEK293T细胞和原代神经元上的表现
那么,eCB2.0能否用来检测神经元释放的eCB ?作者先从体外培养的原代神经元入手,证明eCB2.0能够检测到电刺激引发的来自神经元的eCB释放。通过药理学方法,作者发现此时神经元释放的eCB类型主要为2-AG。此外,作者还发现,即使不给予电刺激,也能记录到离散分布的直径约为10微米的自发性eCB2.0信号,表明eCB的释放具有特异和局部的特性。在急性脑片这一更接近生理条件的体系中,电刺激和高钾溶液刺激均能引起eCB的释放,其局部释放的特点也再次被验证:eCB2.0能够以单个轴突扣结(bouton),即单个突触的空间分辨率,检测到海马体CB1R阳性神经元上的eCB信号(图三)。
图三:急性海马体脑片上由高钾溶液刺激引发及自发的内源大麻素信号具有单个突触的分辨率
基底外侧杏仁核(basolateral amygdala, BLA)是介导恐惧反应和加工厌恶记忆的关键脑区。内源大麻素受体CB1R在此处有高水平的表达。为了研究活体动物在受到伤害刺激时BLA脑区处的eCB动态变化,作者借助AAV病毒在小鼠BLA表达eCB2.0探针并使用光纤记录的手段成功检测到给予小鼠足部电击时的BLA脑区中eCB的信号。另一方面,在海马体CA1脑区,作者使用活体双光子双色显微成像的方式,记录了小鼠跑步时CA1区神经元的钙信号和eCB信号,发现跑步行为总是伴随着CA1神经元的兴奋以及eCB信号的上升,表明eCB2.0探针能够实时检测小鼠在生理条件下(运动过程中)大脑中内源大麻素的动态变化(图四)。

图四:小鼠受到足部电击时BLA脑区的内源大麻素信号和小鼠跑步时海马体CA1脑区的内源大麻素信号
当大脑处于疾病状态时,eCB的释放又会呈现什么样的变化呢?过去的研究发现,内源大麻素系统受损的动物易发癫痫。为了探究癫痫和eCB信号的联系,作者构建了癫痫模型小鼠,并借助双光子成像记录了小鼠癫痫发作时的神经元活动和eCB动态。有意思的是,当小鼠被诱导发生癫痫时,海马体CA1区神经元表现出剧烈的钙信号活动并伴随强烈的eCB信号上升;更有意思的是,紧随着癫痫发作后,作者在CA1脑区记录到了沿着水平方向传递的强烈的“钙波”信号和“eCB波”信号(见视频)。

视频:小鼠癫痫发作前后的海马体CA1脑区的内源大麻素信号和钙信号的变化,注意内源大麻素波和钙波的传递
总而言之,在这项工作中,作者首次实现了对eCB的高时空间分辨率记录,为科学界深入研究内源大麻素在生理和病理条件下的重要功能和调控机理提供了有力的新工具。
值得一提的是,这项研究的合作者美国斯坦福大学Ivan Soltesz实验室借助eCB2.0探针就内源大麻素在大脑中的动态及其在癫痫中的作用进行了更进一步的研究,相关成果同期发表在Neuron杂志上(Farrell et al, 2021)。
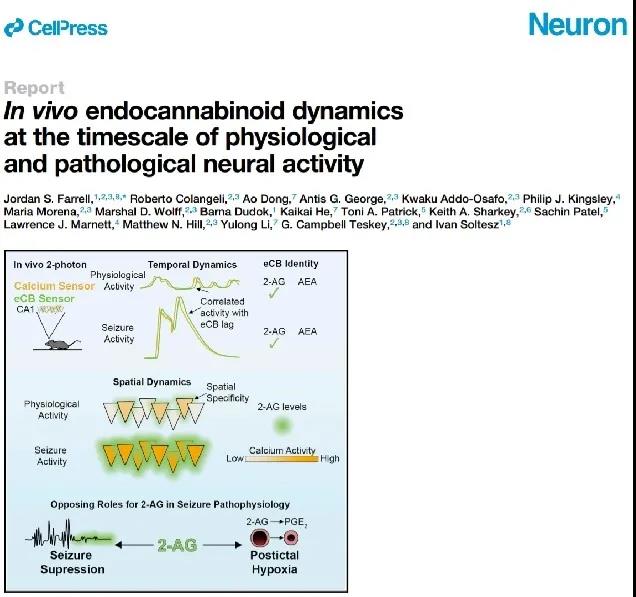
图五:Ivan Soltesz实验室借助eCB2.0探针解析了活体动物海马体内源大麻素信号的分子特性和时空动态。他们发现,相较于正常生理活动时,癫痫引起大量2-AG的释放,而2-AG为长时程的中风样症状提供了基础底物(Farrell et al, 2021)。
生命科学联合中心2021届博士毕业生董傲为本文第一作者,北京大学生命科学学院李毓龙教授为通讯作者。清华大学本科毕业生何凯凯、北京大学博士研究生蔡儒仪、王欢、本科毕业生段佳丽等对文章做出了重要贡献。该工作得到了美国国立卫生研究院David Lovinger实验室、美国冷泉港实验室Bo Li实验室、美国斯坦福大学Jun Ding实验室和Ivan Soltesz实验室等团队的合作,并得到北京大学膜生物学国家重点实验室、生命科学联合中心、国家自然科学基金、北京市科委及美国NIH脑计划等机构和经费的大力支持。
更多李毓龙实验室工作详见:
http://yulonglilab.org/
文章地址:
https://www.nature.com/articles/s41587-021-01074-4

