2018年10月30日,国际顶级期刊《Nature》在线发表了北大-清华生命科学联合中心张泽民课题组与美国安进公司(Amgen)欧阳文军团队及北京大学人民医院申占龙课题组合作完成的题为“Lineage tracking reveals dynamic relationships of T cells in colorectal cancer”的研究论文。该论文对12例结直肠癌患者的癌组织,癌旁组织以及外周血的大量T细胞进行全长转录组的深度测序,创造性地开发了STARTRAC (Single T-cell Analysis by Rna-seq and Tcr TRACking)生物信息方法,对结直肠癌相关T细胞的组织分布特性、克隆性、迁移性和状态转化进行全面刻画;首次从单细胞层面解析基因组微卫星不稳定(Microsatellite instable, MSI)和微卫星稳定(Microsatellite stable, MSS)结直肠癌病人的T细胞亚型及分子差异,并对多癌种的T细胞进行比较分析。
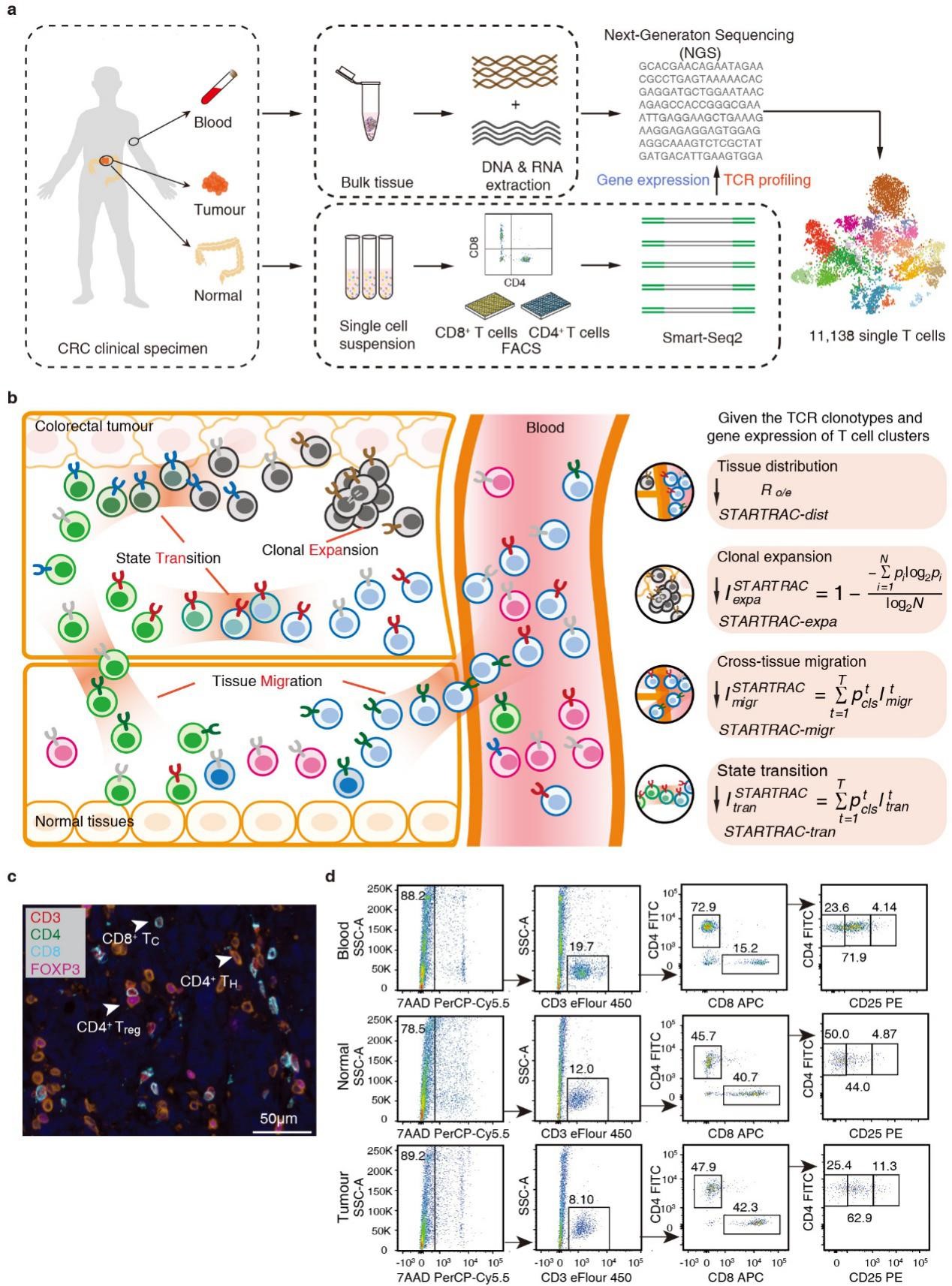
STARTRAC方法定量描绘结直肠癌T细胞的动态变化
肿瘤浸润T细胞作为肿瘤免疫的核心成员,一直是国内外基础及临床研究的热点。对肿瘤微环境中T细胞的分类和亚型鉴定已有一些研究成果,然而如何刻画人体内T细胞的动态变化关系依然是研究的难点。张泽民组利用T细胞受体(TCR)作为标签,追踪同一克隆型(clonotype)T细胞在不同组织或不同状态下的分布,定量刻画、比较不同细胞群的特性。通过STARTRAC的深入分析,研究发现CD8耗竭(exhaustion)T细胞及效应(effector)T 细胞具有最强的克隆增生特性,然而这两群细胞的迁移特性截然不同,耗竭T细胞表现为低迁移、高组织驻留特性,而效应T细胞表现出在组织间及外周血中的迁移潜能,提示除了肿瘤内部,外周组织中的T细胞可能也参与周身抗肿瘤反应。研究发现,与CD8 T细胞相比,CD4 T细胞的克隆增生特性整体较弱。值得注意的是,外周血中的CD4 效应T细胞与CD8效应T细胞具有相似的的克隆增生特性、迁移性及状态变化特性。过往研究主要关注CD8 T 细胞对肿瘤的杀伤作用,而该发现可引发后续对CD4 辅助T细胞与肿瘤杀伤及肿瘤微环境中多种细胞相互作用关系的研究。
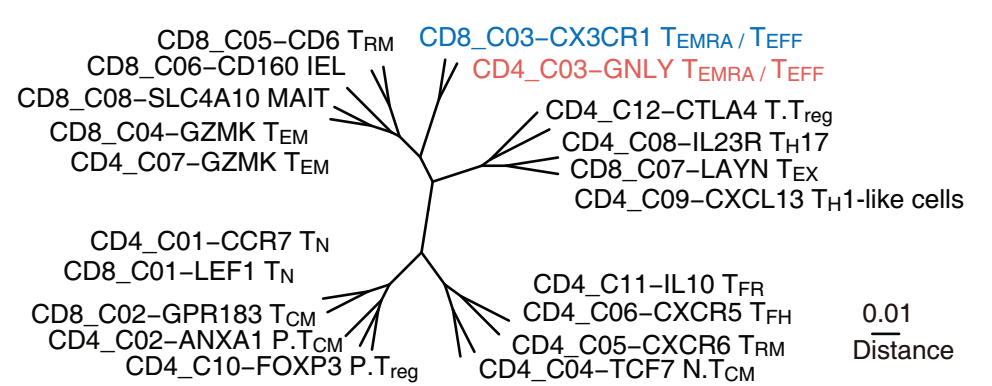
结直肠癌肿瘤浸润 T细胞亚类相似性关系
随着免疫检查点抑制剂(如anti-PD-1)在多种肿瘤临床实验中取得良好疗效,该疗法的实际临床推广前景越来越广。然而临床实验结果显示,仍有一些肿瘤患者疗效较差。结合张泽民组此前发表的肝癌及非小细胞肺癌T细胞的工作,此研究首次对三个癌种的T细胞进行了整合分析及比较,发现相比于血液中的T细胞类群,来自三个癌种患者的癌组织及癌旁组织表现出更强的异质性,如非小细胞肺癌癌组织中有更多的前耗竭T细胞,结直肠癌组织中特异富集CD160高表达的上皮内淋巴细胞(Intraepithelial lymphocytes)以及TH17细胞,癌旁组织中富集更多的滤泡辅助性T细胞(Follicular helper T cell, TFH),提示了器官区域免疫特征对抗肿瘤免疫特征的影响。
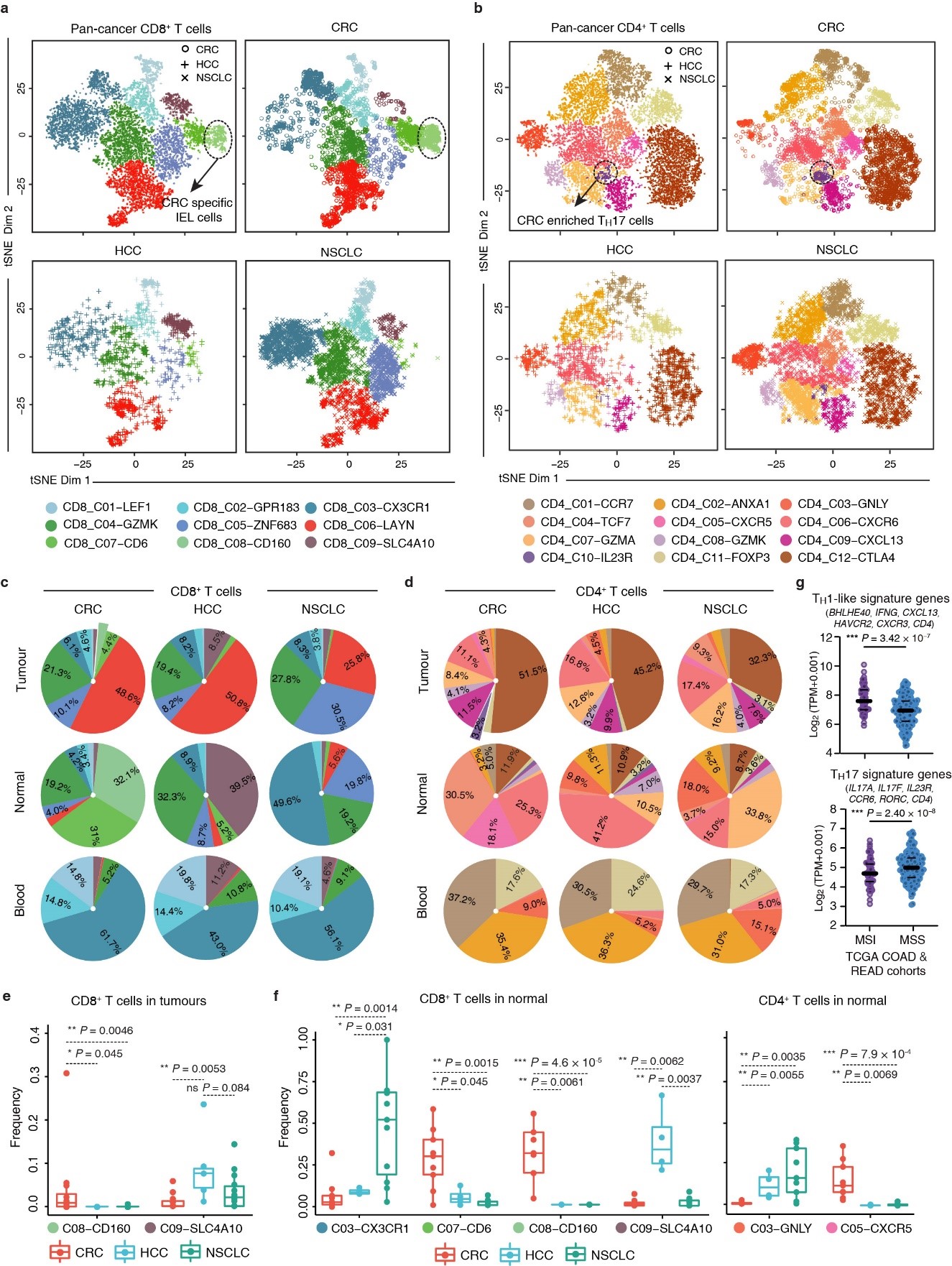
多癌种比较分析得到癌种特异T细胞类群及特征
相较其他癌种,结直肠癌病人基因组的重要特征是区分微卫星序列稳定型(MSS)和不稳定型(MSI),且该特征与免疫检查点抑制剂疗效直接相关,即MSI病人疗效显著优于MSS病人,然而其差异机制有待研究。张泽民组发现TH17细胞富集于MSS病人的肿瘤组织中,而高表达CXCL13的TH1-like细胞(高表达IFNG)在MSI病人中显著富集。深入研究发现,这类细胞同时高表达转录因子BHLHE40,它不仅可以促进产生效应性的IFN-ɣ分子,还可以抑制产生抑制性的IL-10分子,提示CXCL13+ TH1-like细胞可能影响免疫检查点抑制剂的治疗效果。其中IGFLR1是在此类细胞上高表达的一类受体蛋白。通过对IGFLR1及其配体IGFL3的体外实验证明,IGFLR1作为新发现的协同刺激因子,IGFLR1/IGFL3通路可能成为潜在的药物治疗靶点。
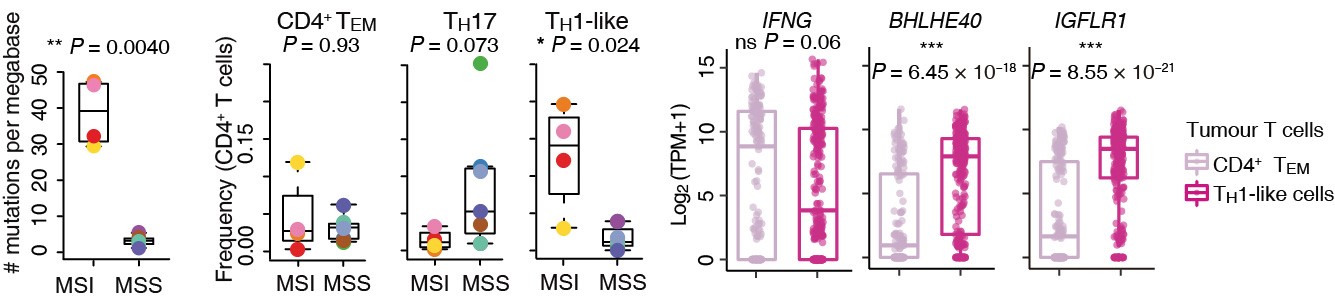
MSI病人显著富集高表达BHLHE40和IGFLR1的CXCL13+ TH1-like细胞
此研究为张泽民组领导的多方合作项目。该项目对结直肠癌中的浸润T细胞亚群进行了鉴定和功能阐释,特别是整合转录组与TCR信息的生物信息方法(STARTRAC)的开发,可以推及到其他肿瘤中T细胞以及B细胞动态关系的研究。
北大-清华生命科学联合中心博士后张雷,美国Amgen科学家Xin Yu,北京大学北大-清华生命科学中心博士生郑良涛(2015级),生命科学学院PTN项目博士生张园园(2015级)为该论文并列第一作者。北京大学生命科学学院BIOPIC中心、北京未来基因诊断高精尖创新中心(ICG)、北大-清华生命科学联合中心张泽民,美国Amgen欧阳文军,及北京大学人民医院胃肠外科申占龙为该论文的共同通讯作者。该研究得到北京未来基因诊断高精尖创新中心(ICG),国家重点研发计划,国家自然科学基金和美国Amgen公司的支持和资助。张雷博士得到北大-清华生命科学联合中心博士后基金的资助。
本文链接::https://www.nature.com/articles/s41586-018-0694-x
(DOI:10.1038/s41586-018-0694-x)

